· Fachbeitrag · Medizinprodukte
Sichere Validierung von Sterilisationsverfahren: Die Voraussetzungen
von Monika Pohlkamp, MFA und Qualitätsmanagerin, Sendenhorst
| Sterilisationsverfahren sind nur dann sicher, wenn sie immer wieder nach denselben Qualitätsstandards ablaufen und beständig sichere Ergebnisse liefern. Die Maßnahmen, die den Nachweis erbringen, dass das Sterilisationsverfahren diese Anforderungen erfüllt, bezeichnet man als Validierung. Die Validierung eines Reinigungs- und Desinfektionsgeräts (RDG) ist vom Betreiber durchzuführen. Sie beginnt mit den organisatorischen Voraussetzungen, die Ihre Praxis zur Validierung erfüllen muss. Welche das sind, fasst PPA für Sie zusammen. |
Validierung und Qualitätsmanagement
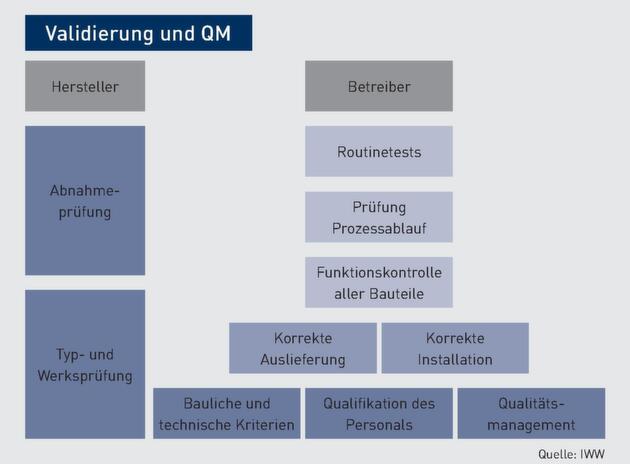
Die Validierung eines RDG durch den Anwender umfasst mehrere Komponenten und ist nicht zu verwechseln mit der Typ- und Werksprüfung bzw. der Abnahmeprüfung, die unter das Qualitätsmanagement (QM) des Herstellers fällt.

Bauliche Voraussetzungen der Praxis
Die Praxis muss über einen eigenen Aufbereitungsraum verfügen, der den Anforderungen des Robert Koch-Instituts (RKI) genügt (siehe weiterführende Hinweise). Dieser muss unter anderem aufgeteilt sein in eine „reine“ und eine „unreine“ Seite. Lesen Sie dazu auch den Beitrag „Praxisbegehungen durch das Gesundheitsamt: Überprüfung der Infrastruktur“ (PPA 12/2013, Seite 15).
Darüber hinaus muss der Raum so dimensioniert sein, dass das RDG sachgerecht installiert werden kann. Achten Sie dabei auch auf die entsprechenden Anschlüsse (Wasser, Abwasser, Abluft, Druckluft und Strom).
PRAXISHINWEIS | Ist in der Praxis kein eigener Aufbereitungsraum vorhanden, kann zur Aufbereitung auch das Praxislabor genutzt werden. In diesem Fall ist eine entsprechende Dokumentation in der Arbeitsanweisung zur Instrumentenaufbereitung für das Praxispersonal notwendig, die im QM der Praxis zu implementieren ist. Einen Link zu einem Muster finden Sie in den weiterführenden Hinweisen. |
Hygienebeauftragte und Qualifikation des Personals
Nach der Verordnung über die Hygiene und Infektionsprävention in medizinischen Einrichtungen (HygMedVO) vom 13. März 2012 benötigen Krankenhäuser und Einrichtungen für ambulantes Operieren eine qualifizierte Hygienebeauftragte. Hygieniker und QM-Fachleute empfehlen eine solche aber auch für Praxen mit mehr als zehn Vollzeitkräften. In kleineren Praxen muss die Hygienebeauftragte nur benannt sein. Sie muss aber Hygieneschulungen nachweislich besucht haben und diese alle zwei Jahre wiederholen.
Alle anderen MFA, die in der Praxis Medizinprodukte aufbereiten, benötigen einen qualifizierten Sachkundenachweis. Der entsprechende Fachkundelehrgang umfasst mittlerweile 40 Unterrichtsstunden, aufgeteilt auf 20 Unterrichtsstunden Präsenzkurs und 20 Unterrichtsstunden Selbststudium. Nähere Informationen erhalten Sie bei Ihrer Landesärztekammer oder auf der Homepage der Deutschen Gesellschaft für Sterilgutversorgung e.V. (DGSV, siehe weiterführende Hinweise).
Qualitätsmanagement
Im QM der Praxis ist die Dokumentation unerlässlicher Bestandteil der Validierung von RDG. Sie dient dem Nachweis der Einhaltung vorgeschriebener Qualitätsstandards und kann im Haftungsfall als juristisches Beweismittel verlangt werden. Daher sollte sie sorgfältig aufbewahrt werden bzw. jederzeit verfügbar sein. (Für Muster der Arbeitsanweisungen, Fehlerprotokolle und Formblätter siehe weiterführende Hinweise.) Zur Dokumentation gehören:
- Arbeitsanweisungen, in denen genau beschrieben wird, wie, wann, womit und durch wen die Medizinprodukte aufbereitet werden,
- Fehlerprotokolle, in denen alle Fehlermeldungen des RDG erfasst werden,
- Formblätter zur Fehlermeldung an den Hersteller, das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) oder andere zuständige Stellen
- und Gebrauchsanweisungen des RDG.
PRAXISHINWEIS | Vergewissern Sie sich bei Auslieferung des Geräts, dass Sie alle erforderlichen Unterlagen - so auch die Gebrauchsanweisung - erhalten. Stellt Ihnen der Hersteller unvollständige Unterlagen zur Verfügung, verstößt er gegen das Medizinproduktegesetz. |
Risikoeinstufung
Um festzulegen, welches Medizinprodukt wie aufzubereiten ist, muss in der Praxis eine Risikoeinstufung aller Medizinprodukte vorgenommen werden.
| ||
Risikogruppe | Kontaktpunkt | Beispiel |
A: unkritisch | intakte Haut | EKG-Elektroden |
B: semi-kritisch | Schleimhaut, krankhaft veränderte Haut | Endoskop |
C: kritisch | Blut, inneres Gewebe, Organe, Wunden | Wundhaken |
Beachten Sie | Medizinprodukte der Risikogruppe B müssen grundsätzlich maschinell aufbereitet werden. Medizinprodukte der Risikogruppe C dürfen nur in Einrichtungen aufbereitet werden, die nach einem QM-System nach DIN EN ISO 13485 in Verbindung mit der Empfehlung der Kommission für Krankenhaushygiene und Infektionsprävention (KRINKO) extern zertifiziert sind.
FAZIT | Erst wenn Ihre Praxis die bis hierhin beschriebenen Voraussetzungen erfüllt, dürfen Sie das RDG validieren und in Betrieb nehmen. Was Sie dabei beachten müssen, lesen Sie in PPA 11/2014. |
Weiterführende Hinweise
- RKI-Richtlinien zur Aufbereitung von Medizinprodukten als PDF zum Download unter http://tinyurl.com/lkwm96z
- Homepage der DGSV www.dgsv-ev.de
- Homepage des Normenausschusses Medizin (NaMed): www.named.din.de
- Die Muster-Arbeitsanweisung zur Instrumentenaufbereitung und alle anderen hier erwähnten Muster finden Sie unter ppa.iww.de > Downloads > Arbeitshilfen.



















