· Fachbeitrag · Medizinprodukte
Arbeitsschritte bei der Aufbereitung von Instrumenten
von Marie Reiter, MFA, Düsseldorf, www.deinberichtsheft.de
I Zur Einhaltung der gesetzlich vorgegebenen Hygienestandards gehört auch die fachgerechte Aufbereitung von Medizinprodukten. Je nach Risikoklasse sind Medizinprodukte unterschiedlich aufzubereiten. PPA gibt einen Überblick über die Risikoeinstufung und die jeweiligen Aufbereitungsverfahren. |
Gesetzliche Grundlagen
§ 4 Medizinprodukte-Betreiberverordnung gibt dem Betreiber für die ordnungsgemäße Aufbereitung ein bestimmtes Regelwerk vor. Es handelt sich um die gemeinsame „Empfehlung der Kommission für Krankenhaushygiene und Infektionsprävention (KRINKO) am Robert Koch-Institut (RKI) und des Bundesinstituts für Arzneimittel und Medizinprodukte (BfArM) zu den Anforderungen an die Hygiene bei der Aufbereitung von Medizinprodukten“. Diese Norm wird abgekürzt mit KRINKO(RKI)BfarM 2012.
Risikoeinstufung von Medizinprodukten
Die KRINKO(RKI)BfarM 2012 schreibt in Anlage 8 unter anderem eine Risikoeinstufung von Medizinprodukten vor (siehe PPA 01/2014, Seite 12):
- Unkritische Medizinprodukte kommen lediglich mit intakter Haut in Kontakt (z. B. EKG-Elektroden, Pinzette, Verbandsschere, Stethoskop, Ultraschallköpfe).
- Semikritische Medizinprodukte kommen mit Schleimhaut oder krankhaft veränderter Haut in Kontakt (z. B. Pflegeutensilien für den Mundraum, Klemmen, Zangen, Tubus, Spekulum).
- Kritische Medizinprodukte kommen mit Blut, innerem Gewebe oder Organen in Kontakt (z. B. Skalpell, Wundhaken, Injektionsspritze).
Innerhalb ihrer Risikoklassen werden Medizinprodukte - je nach Anforderungen an ihre Aufbereitung - noch in die Gruppen A und B (semikritisch) bzw. A, B und C (kritisch) eingestuft: z. B. gehören massive, glatte Instrumente (z. B. Klemme) zu Gruppe A, Instrumente mit Hohlräumen (z. B. flexibles Endoskop) zur Gruppe B.
PRAXISHINWEIS | Medizinprodukte der Gruppe B sollten bevorzugt maschinell aufbereitet werden, eine validierte manuelle Aufbereitung ist jedoch nicht ausgeschlossen. Medizinprodukte der Risikoklasse C dürfen nur in Einrichtungen aufbereitet werden, die nach DIN EN ISO 13485 und der Empfehlung der Kommission für Krankenhaushygiene und Infektionsprävention (KRINKO) arbeiten. In der Hausarztpraxis werden Medizinprodukte der Gruppe C meist nicht verwendet. |
Manuelle Aufbereitung
Die manuelle Aufbereitung von Medizinprodukten läuft in allen Praxen auf die gleiche Weise ab. Folgendes Flussdiagramm stellt den manuellen Aufbereitungsprozess für unkritische und semikritische Medizinprodukte dar.
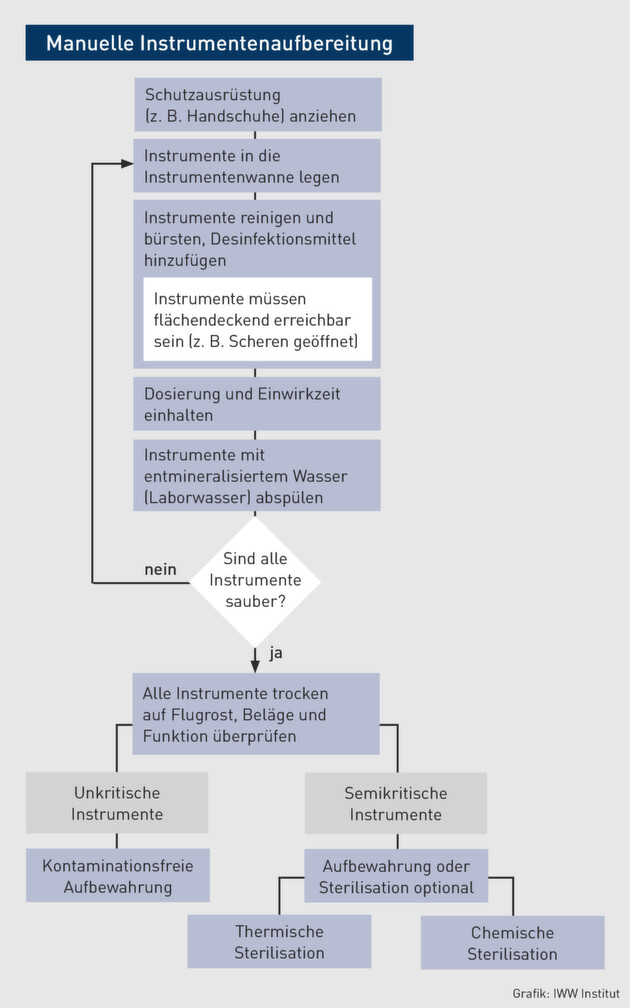

Eine fachgerechte manuelle bzw. chemische Desinfektion der Instrumente wird durch Desinfektionsmittel (z. B. Aldehyde, Phenole) erreicht. Das RKI legt für geeignete Desinfektionsmittel folgende Grundvoraussetzungen fest:
- Breites Wirkungsspektrum (gegen Keime der Gruppen A, B, C und D, Definition online unter http://tinyurl.com/j4nq7yj)
- Kurze Einwirkzeit
- Irreversible Wirkung
- Materialverträglichkeit
- Biologische Abbaubarkeit
- Geringe Abwassertoxizität
PRAXISHINWEIS | Halten Sie die Herstellerangaben und die Empfehlungen zu persönlichen Schutzmaßnahmen unbedingt ein. Welche Desinfektionsmittel die Vorgaben des RKI erfüllen, erfahren Sie über die IHO-Viruszidieliste (online frei zugänglich unter http://tinyurl.com/glyyqr7) und die VAH-Desinfektionsmittelliste (kostenpflichtig zu bestellen online unter http://tinyurl.com/he3c5pn). |
Maschinelle Aufbereitung
Die maschinelle Aufbereitung gilt im Vergleich zur manuellen Aufbereitung als effektiver und umweltfreundlicher. Laut RKI geht die Empfehlung heute dahin, ein Reinigungs- und Desinfektionsmittelgerät (RDG) zur Aufbereitung von Medizinprodukten einzusetzen. Ein RDG reinigt die Medizinprodukte mit Dampf und desinfiziert sie gleichzeitig mit integrierten Desinfektionsmitteln. Die maschinelle Aufbereitung kommt natürlich nur für Medizinprodukte infrage, die unempfindlich gegen Hitze (thermostabil) sind. Obwohl Ihnen das RDG einen Großteil der Arbeit bei der Aufbereitung abnimmt, müssen Sie es richtig einsetzen und bedienen.
|
|
Weiterführende Hinweise
- „Sichere Validierung von Sterilisationsverfahren: Die Voraussetzungen“ (PPA 10/2014, Seite 18).
- „Sichere Validierung von Sterilisationsverfahren: Prüfverfahren zur Validierung“ (PPA 11/2014, Seite 14).



















